Monofuncionalización de β-ciclodextrinas con un reactivo supramolecular, es el título del estudio experimental para el trabajo de fin de máster en el que se encuentra investigando Bayron Sandoval García, que actualmente estudia el Máster en Química Supramolecular, en la facultad de ciencias químicas de la Universidad de Salamanca, Castilla y León, España. Es ingeniero químico por la Universidad Rafael Landívar de Guatemala y posee una especialización en Energía por la misma universidad.
Las ciclodextrinas son compuestos hidrosolubles, debido a la gran cantidad de hidroxilos capaces de formar enlaces de hidrógeno, pero su principal propiedad es que cierran una cavidad en la que los enlaces de carbono hidrógeno de los carbonos C-3 y C-5 establecen un ambiente apolar en el que se pueden asociar moléculas orgánicas dando lugar a complejos de inclusión. Esta propiedad de las ciclodextrinas ha hecho que sean compuestos con una gran cantidad de aplicaciones en industria y en aplicaciones terapéuticas, ya que facilitan el transporte de los medicamentos a los centros activos en los que los actúa el principio activo.
Pese a que la formación del complejo de inclusión debería generar buenos rendimientos en las monosulfonilciclodextrinas, estos son pobres, alrededor del 15% debido a que el agua, que es mucho más abundante en el medio de reacción, compite con ventaja con el hidroxilo de la ciclodextrina que es mucho menos nucleófilo.
Con objeto de diseñar un mejor reactivo que los anteriores, Breslow1 optimizó la geometría de los substratos para llevar a cabo la reacción de acilación de ciclodextrinas. Los resultados muestran que los acetatos fenólicos acilan las ciclodextrinas en las posiciones C-2 o C-3, es decir que los hidroxilos secundarios de la ciclodextrina son menos nucleófilos que los hidroximetilos, y todavía menos que las moléculas de agua. Este efecto, se debe a que la ciclodextrina asocia el acetato fenólico, de manera que el grupo de acetilos queda próximo a los hidroxilos secundarios de la ciclodextrina.
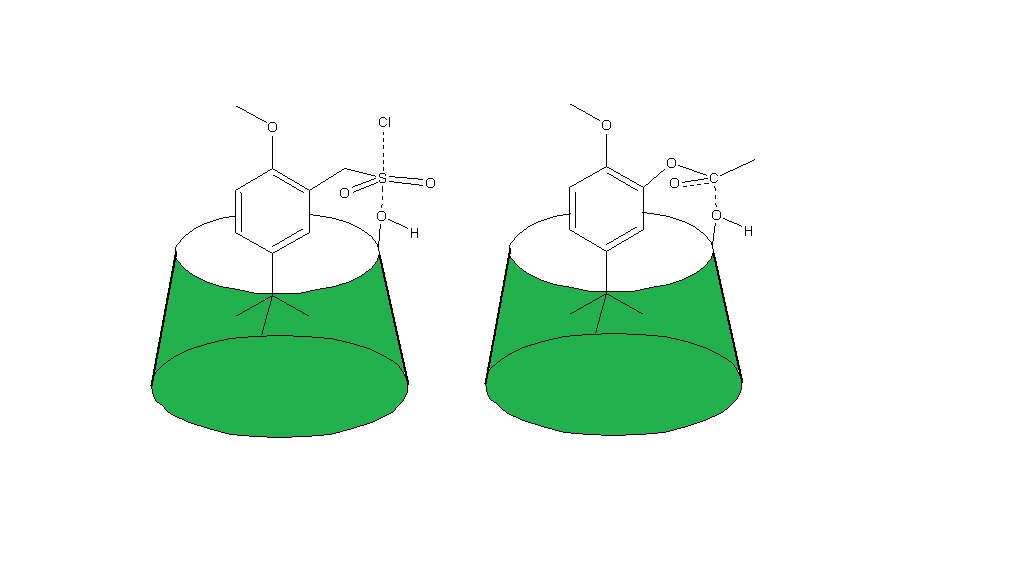
Figura 1: Estados de transición propuestos para las reacciones de sulfonación y acetilación de ciclodextrinas. La figura de la izquierda corresponde al reactivo sintetizado en este trabajo de investigación, el de la derecha, el acetato de fenilo, es el sintetizado por Breslow en su estudio de formación de complejos de inclusión.
Como puede verse en la figura 1, los dos estados de transición presentan geometrías muy similares, por este motivo, una vez formado el asociado con la sulfona bencílica, el hidroxilo de las posiciones C-2 o C-3, debe quedar próximo al grupo sulfonilo, y el efecto de proximidad debería favorecer la formación del nuevo enlace oxígeno-azufre, actuando el cloruro como grupo saliente.
El diseño del reactivo incluye en grupo terc-butilo en posición meta al grupo metilsulfonilo, debido a que es el que presenta la geometría más adecuada para favorecer la proximidad del grupo sulfonilo y los hidroxilos de C-2 y C-3. Por parte, el metiléter se ha incluido en la molécula debido a que dirige la sustitución electrófila a la posición orto, y por ello esperamos que la preparación del reactivo sea más sencilla. Una vez el hidroxilo de las posiciones C-2 o C-3 se haya sulfonado, el grupo terc-butilfenilo ocupa la cavidad de la ciclodextrina.
Es posible la sulfonación de otro hidroxilo de la ciclodextrina con el exceso de reactivo sulfonante, sin embargo, la cavidad ya está ocupada, por lo que no es posible la formación de un nuevo asociado. En estas condiciones, se espera que se obtenga esencialmente solo el compuesto de monosulfonación, ya que la disulfonación debe ser un proceso mucho más lento, pues debe presentar una entropía de activación mucho más elevada.
****
Bibliografía
BRESLOW, Ronald (1980). Departamento de Química, Universidad de Nueva York. Adjusting the Lock and Adjusting the Key in Cyclodextrin Chemistry, Recuperado de https://pubs.acs.org/doi/pdf/10.1021/ba-1980-0191.ch001